修回日期: 2021-07-29
接受日期: 2021-08-24
在线出版日期: 2021-10-08
非选择性β受体阻滞剂(non-selective β-blockers, NSBBs)是肝硬化背景下门静脉高压症的主要治疗方法, 肝硬化患者慢加急性肝衰竭的研究表明, 应用NSBBs后慢加急性肝衰竭分级、白细胞计数以及血浆C反应蛋白(C reactive protein, CRP)水平降低, 进而提出NSBBs具有抗炎作用.
基于竞争风险模型分析NSBBs对晚期慢性肝病炎症因子及预后的影响.
收集本院使用NSBBs治疗的晚期慢性肝病患者319例, 比较治疗前后肝静脉压力梯度(hepatic venous pressure gradient, HVPG)及炎症因子水平变化, 采用竞争风险模型分析治疗后白细胞计数(white blood cell count, WBC)变化对失代偿率及肝相关病死率的影响.
NSBBs治疗后HVPG、WBC及C反应蛋白比治疗前明显降低(P<0.05). 将肝移植和非肝相关病死设为竞争风险, 发现WBC应答(下降≥20%)可降低基线失代偿患者的进一步失代偿风险(HR = 0.708); WBC应答是无肝移植者肝相关生存的独立预测因子(HR = 0.582); WBC应答增加了肝移植者肝相关病死风险(HR = 1.759).
NSBBs有助于改善晚期慢性肝病的炎症反应, 且在Child-Pugh C级患者中表现更明显, WBC下降≥20%可降低进一步失代偿及无肝移植者肝相关病死风险.
核心提要: 国外多项研究表明, 非选择性β受体阻滞剂(non-selective β-blockers, NSBBs)还可明显减轻全身性炎症反应, 但尚未明确NSBBs对全身性炎症的抗炎作用是否有助于改善此类临床结局. 因此, 本研究采用竞争风险模型分析NSBBs对晚期慢性肝病炎症因子及预后的影响, 以供临床借鉴.
引文著录: 王艳娇, 朱雅碧, 魏雯佳. 非选择性β受体阻滞剂对晚期慢性肝病炎症因子及预后的影响. 世界华人消化杂志 2021; 29(19): 1110-1117
Revised: July 29, 2021
Accepted: August 24, 2021
Published online: October 8, 2021
Non-selective β-blockers (NSBBs) are the main treatment for portal hypertension in the context of liver cirrhosis. Studies of acute-on-chronic liver failure in patients with liver cirrhosis have shown that the application of NSBBs decreases the grades of liver failure, white blood cell count (WBC), and plasma C reactive protein (CRP) levels, suggesting that NSBBs have anti-inflammatory effects.
To determine the effects of NSBBs on inflammatory factors and prognosis in advanced chronic liver disease based on a competitive risk model.
A total of 319 patients with advanced chronic liver disease treated with NSBBs at our hospital were included. The changes of hepatic venous pressure gradient (HVPG) and inflammatory factor levels before and after treatment were compared. A competitive risk model was used to analyze the effect of changes in WBC after treatment on the decompensation rate and liver-related mortality.
HVPG, WBC, and CRP after NSBBs treatment were significantly lower than the values before treatment (P < 0.05). Taking liver transplantation and non-liver-related deaths as competitive risks, it was found that WBC response (decreased by ≥ 20%) can reduce the risk of further decompensation in patients with baseline decompensation (hazard ratio [HR] = 0.708). WBC response was identified to be an independent predictor of liver-related survival in patients without liver transplantation (HR = 0.582). WBC response increased the risk of liver-related death in liver transplant patients (HR = 1.759).
NSBBs help to improve the inflammatory response in advanced chronic liver disease, which is more obvious in Child-Pugh C patients. A decrease of ≥ 20% in WBC can reduce the risk of liver-related death in patients with further decompensation and without liver transplantation.
- Citation: Wang YJ, Zhu YB, Wei WJ. Effect of non-selective β-receptor blockers on inflammatory factors and prognosis in advanced chronic liver disease. Shijie Huaren Xiaohua Zazhi 2021; 29(19): 1110-1117
- URL: https://www.wjgnet.com/1009-3079/full/v29/i19/1110.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i19.1110
晚期慢性肝病是全球普遍存在的严重健康问题, 与高发病率和高病死率有关[1]. 门静脉高压是慢性肝病的重要病理变化, 具有临床意义的门静脉高压症[肝静脉压力梯度(hepatic venous pressure gradient, HVPG)≥10 mm Hg]发展会导致肝失代偿和肝硬化其他并发症[2]. 目前认为, 门静脉高压症患者胃肠道粘膜屏障的改变可导致病理性细菌移位, 进而引起内皮功能障碍和全身性炎症反应[3]. 而晚期肝硬化患者的白细胞计数(white blood cell count, WBC), 血浆C反应蛋白(C reactive protein, CRP)等全身炎症标志物, 以及白介素6 (interleukin-6, IL-6)和降钙素(procalcitonin, PCT)等促炎细胞因子可呈现出明显升高的趋势[4,5]. 普萘洛尔、卡维地洛等非选择性β受体阻滞剂(Non-selective beta blockers, NSBBs)是预防原发性和继发性出血的重要药物, 其可降低静脉曲张破裂出血、腹水以及其他代偿失调事件的风险[6]. 此外, 国外多项研究表明, NSBBs还可明显减轻全身性炎症反应[7,8], 但尚未明确NSBBs对全身性炎症的抗炎作用是否有助于改善此类临床结局. 因此, 本研究采用竞争风险模型分析NSBBs对晚期慢性肝病炎症因子及预后的影响, 以供临床借鉴.
一般资料: 回顾性收集本院2013-01/2020-02使用NSBBs治疗的晚期慢性肝病患者319例. 纳入标准: (1)根据瞬时弹性成像、组织学和(或)放射学或典型肝硬化临床表现诊断为晚期慢性肝病; (2)年龄≥18岁; (3)HVPG基线水平≥10 mm Hg; (4)有NSBBs治疗后第二次HVPG检测数据; (5)本研究所需实验室数据完整. 排除标准: (1)肝细胞癌; (2)肝移植; (3)窦性血管性肝病; (4)经颈静脉肝内门体静脉内支架分流术; (5)两次HVPG检测期间实施抗病毒治疗或存在活动性感染. 本研究已获得医院伦理委员会批准, 回顾性研究免除患者知情同意书.
1.2.1 晚期慢性肝病定义: 有病毒性肝炎, 长期大量饮酒等可能引发肝硬化的病史, 临床表现主要为肝功能减退和门静脉高压, B超或CT提示肝硬化以及内镜发现食管胃底静脉曲张, 组织病理学提示肝脏弥漫性纤维化、再生结节及假小叶形成.
1.2.2 HVPG检测: 监测前嘱患者空腹>2 h并静息15 min, 监护仪连接压力传感器, 然后将连接管内空气排净, 在患者腋中线水平固定换能器并接通大气校零; 常规消毒铺巾和局麻, 右侧颈内静脉穿刺, 先行肝静脉造影选择最佳测压静脉血管, 然后经导丝引入球囊导管并连接压力转换器连接管, 对肝静脉自由压和肝静脉楔压进行2次测量, 最终根据公式计算出肝静脉压力梯度(取2次测量计算所得的平均值)[9].
1.2.3 全身性炎症生物标志物检测: 分别于肝静脉压力梯度基线测量以及随访第二次测量时, 抽取患者外周血检测WBC、CRP、IL-6以及PCT水平. 其中WBC、CRP等常规实验室参数采用标准化实验室方法测定, IL-6以及PCT采用化学发光免疫测定法测定.
1.2.4 基线时疾病失代偿定义: 分析患者病史记录, 存在如下失代偿事件则定义为基线时失代偿: (1)食管静脉曲张破裂出血史. 确诊胃底-食管静脉曲张的患者通过内窥镜观察到食管静脉曲张活动性出血或上消化道出血; (2)合并腹水或经腹腔大量穿刺放液史; (3)肝性脑病入院史.
1.2.5 随访临床结局事件定义: 在随访期间发现以下事件则判定为首次或进一步失代偿: (1)食管静脉曲张破裂出血; (2)利尿治疗时出现明显腹水或需要腹腔大量穿刺放液/经颈静脉肝内门体静脉内支架分流术控制; (3)因肝性脑病入院(WestHaven Ⅲ-Ⅳ级)或开始肝性脑病治疗; (4)自发性细菌性腹膜炎. 腹水多形核白细胞计数≥250/mm3[10], 且无其他腹腔内感染源; (5)因其他重大感染入院; (6)慢加急性肝衰竭; (7)与肝相关病死. 包括肝衰竭、肝性脑病、肝肾综合征、食管胃底静脉曲张破裂出血、肝硬化相关感染、肝肺综合征等肝硬化相关并发症或者与肝代偿失调有关的任何事件导致的病死, 或无明显的非肝相关病死原因而因肝细胞癌导致的病死; (8)非肝相关病死. 除外所有肝相关病死事件导致的病死.
分析所有可能对结局具有临床意义的数据, 以及患者HVPG基线测量(治疗前)至第二次测量时(治疗后)全身炎症指标变化; 分别记录基线有无失代偿患者治疗后首次失代偿(基线无失代偿)、进一步失代偿(基线时有失代偿)、肝相关病死和肝移植情况, 以及上述事件出现的时间; 分析WBC反应最佳临界值及其对预后的预测价值.
统计学处理 本研究数据采用SPSS 26.0和R软件进行分析. 定性数据采用例数和构成比表示, 组间比较采用χ2或Fisher精确检验; 定量数据经正态性检验, 符合正态分布采用(mean±SD)表示, 非正态分布则采用中位数(四分位间距)表示, 根据变量特点采用t检验、Mann-Whitney U检验、方差分析或Kruskal-Wallis检验; 使用Kaplan-Meier法和log-rank检验分析与时间相关事件; 采用ROC曲线确定WBC预测肝相关病死率的最佳应答临界值. 在R软件的Cmprsk程序包中采用Fine和Gray提出的竞争风险回归法[11], 将肝移植和非肝相关的病死设为竞争风险, 分析NSBBs相关的炎症水平变化对代偿失调和肝相关病死风险的影响. 在所有模型中, 均将WBC降低≥20%作为NSBBs相关全身性炎症水平改善的替代标志物, 并筛选出单因素分析存在差异的变量(P≤0.10)进行多因素分析, P<0.05则说明具有统计学意义.
入选的319例患者中, 男239例, 女80例; 中位年龄57 (43, 64)岁; 病因: 病毒性肝炎179例, 酒精性肝炎71例, 酒精性肝炎+病毒性肝炎22例, 其他47例; Child-Pugh分级: A级78例, B级167例, C级74例; 肝硬化程度: 失代偿期239例, 代偿期80例; 静脉曲张: 有306例, 无13例; 出血史: 有99例, 无220例; 腹水严重程度: 少量121例, 中量138例, 大量60例; 肝性脑病: 有96例, 无223例; HVPG基线值为20 (16, 24) mm Hg; 终末期肝病模型(MELD-Na)中位评分11 (8, 17)分.
319例晚期慢性肝病患者中, 有198例使用卡维地洛治疗, 121例使用普萘洛尔治疗; 除了16例(5.02%)患者在两次HVPG检测期间使用利福昔明预防肝性脑病外, 其余患者均未使用任何抗生素. 在采用NSBBs治疗后进行再次行HVPG检测的中位时间为33 (27, 43)d, 治疗后HVPG应答情况: 降低<10% 者25例, 降低10%-19%者182例, 降低20%者112例. NSBBs治疗后患者的HVPG、WBC及CRP相比治疗前明显降低(P<0.05). 见表1.
| 项目 | 治疗前 | 治疗后 | △(%) | Z | P |
| HVPG (mm Hg) | 20 (16, 24) | 18 (13, 21) | -12 (-25, 0) | 6.193 | <0.001 |
| WBC (g/L) | 4.80 (3.27, 6.51) | 4.63 (3.19, 6.24) | -2 (-18, +13) | 2.295 | 0.019 |
| CRP (mg/dL) | 0.49 (0.18, 1.09) | 0.34 (0.16, 0.88) | -14 (-45, +18) | 8.204 | <0.001 |
| PCT (ng/mL) | 0.14 (0.06, 0.19) | 0.11 (0.07, 0.17) | -3 (-26, +20) | 1.516 | 0.301 |
| IL-6 (pg/mL) | 10.75 (6.64, 23.85) | 11.39 (6.51, 21.54) | -8 (-39, +35) | 1.305 | 0.496 |
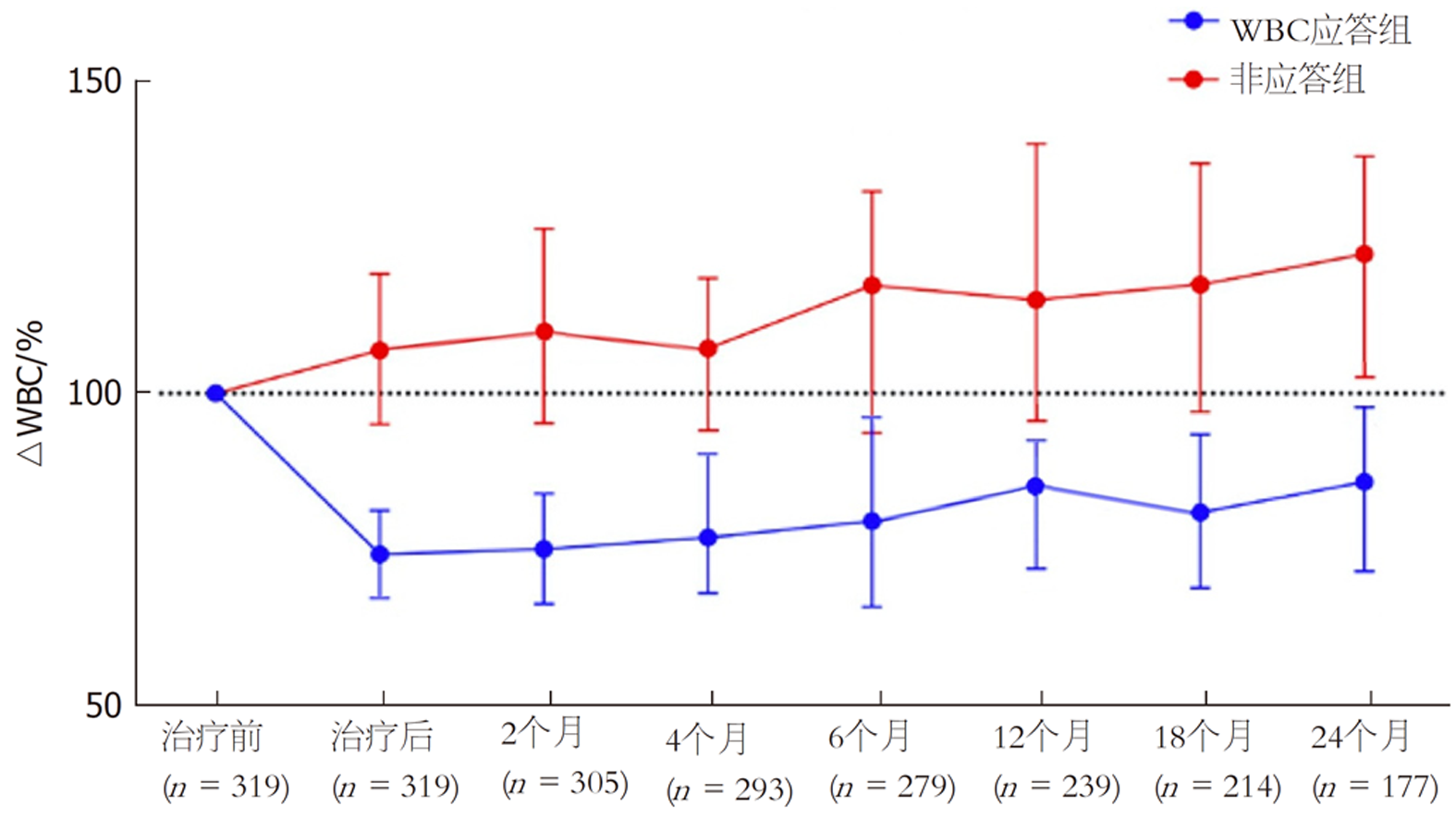
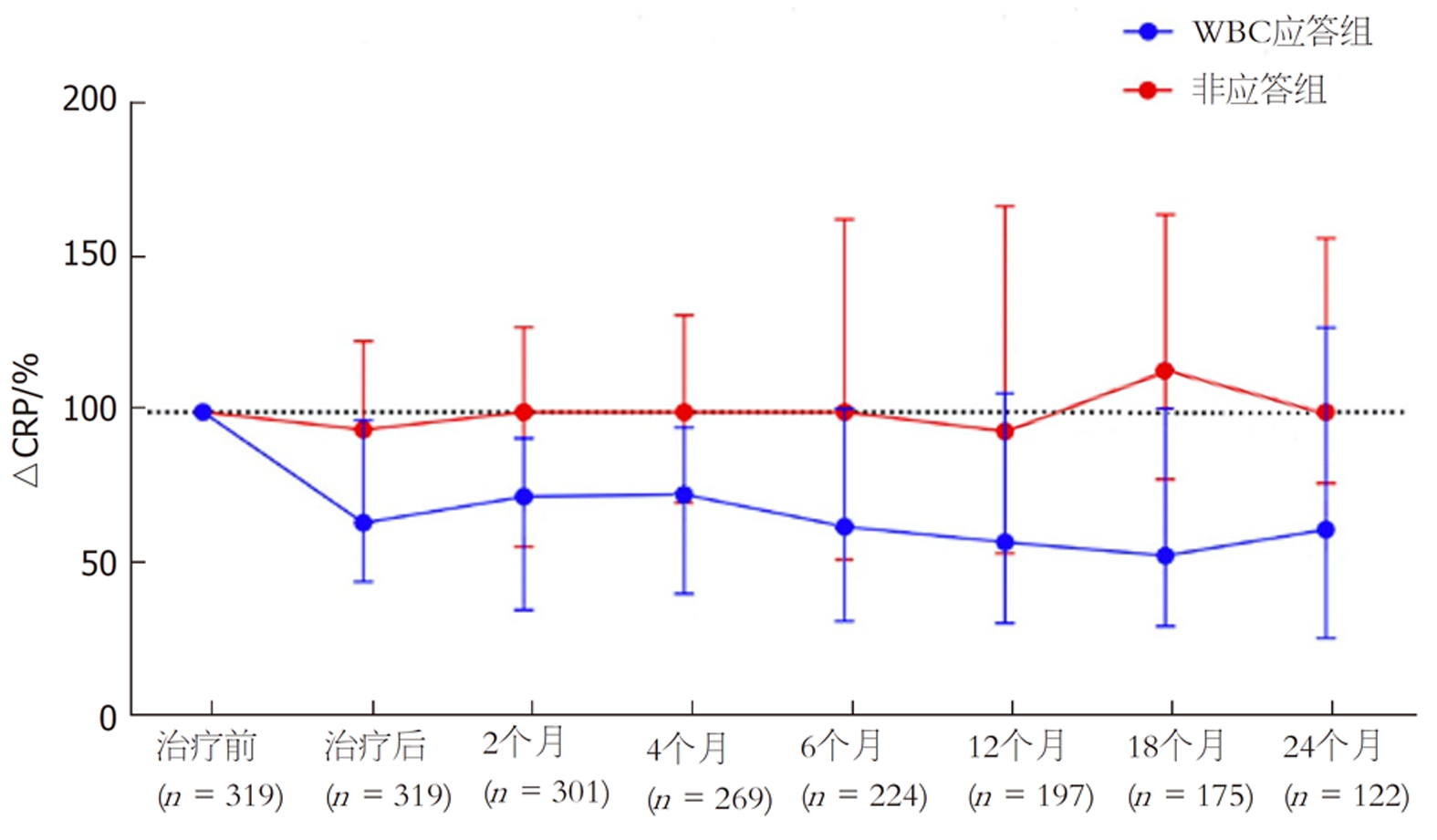
ROC曲线确定WBC预测肝相关病死率的临界值为WBC降低20%, 曲线下面积为0.825, 约登指数为0.640; 以此为依据对患者进行分组, 其中WBC应答组96例, 非应答组223例, 两组基线时的Child-Pugh分级、WBC以及CPS比较有统计学意义(P<0.05), 见表2. 两组年龄、性别、肝硬化程度、腹水严重程度及转氨酶等无统计学意义的指标因文章篇幅过大在此不赘述. 此外, WBC应答组随访24 mo内的WBC及CRP水平与基线时相比的中位百分比降低幅度明显低于非应答组, 见图1、图2.
| 项目 | 应答组(n = 96) | 非应答组(n = 223) | Z | P |
| Child-Pugh分级 | -3.654 | <0.001 | ||
| A | 14 (14.58) | 76 (34.08) | ||
| B | 44 (45.83) | 91 (40.81) | ||
| C | 38 (39.58) | 56 (25.11) | ||
| HVPG (mm Hg) | 21 (17, 25) | 20 (18, 24) | 1.141 | 0.133 |
| WBC (g/L) | 6.17 (4.59, 8.46) | 4.26 (3.09, 6.14) | 7.329 | <0.001 |
| CRP (mg/dL) | 0.81 (0.34, 1.65) | 0.40 (0.17, 0.93) | 10.016 | <0.001 |
| PCT (ng/mL) | 0.16 (0.09, 0.25) | 0.13 (0.06, 0.18) | 1.849 | 0.072 |
| IL-6 (pg/mL) | 11.64 (6.96, 34.59) | 9.98 (6.07, 21.25) | 1.082 | 0.175 |
319例患者采用NSBBs治疗后随访时间2-65 mo, 中位随访时间为35 mo. 19例(5.96%)接受了肝移植, 120例(37.62%)和17例(5.33%)的患者因肝相关和非肝相关原因病死, 随访期间有27例(8.46%)被诊断为肝细胞癌.
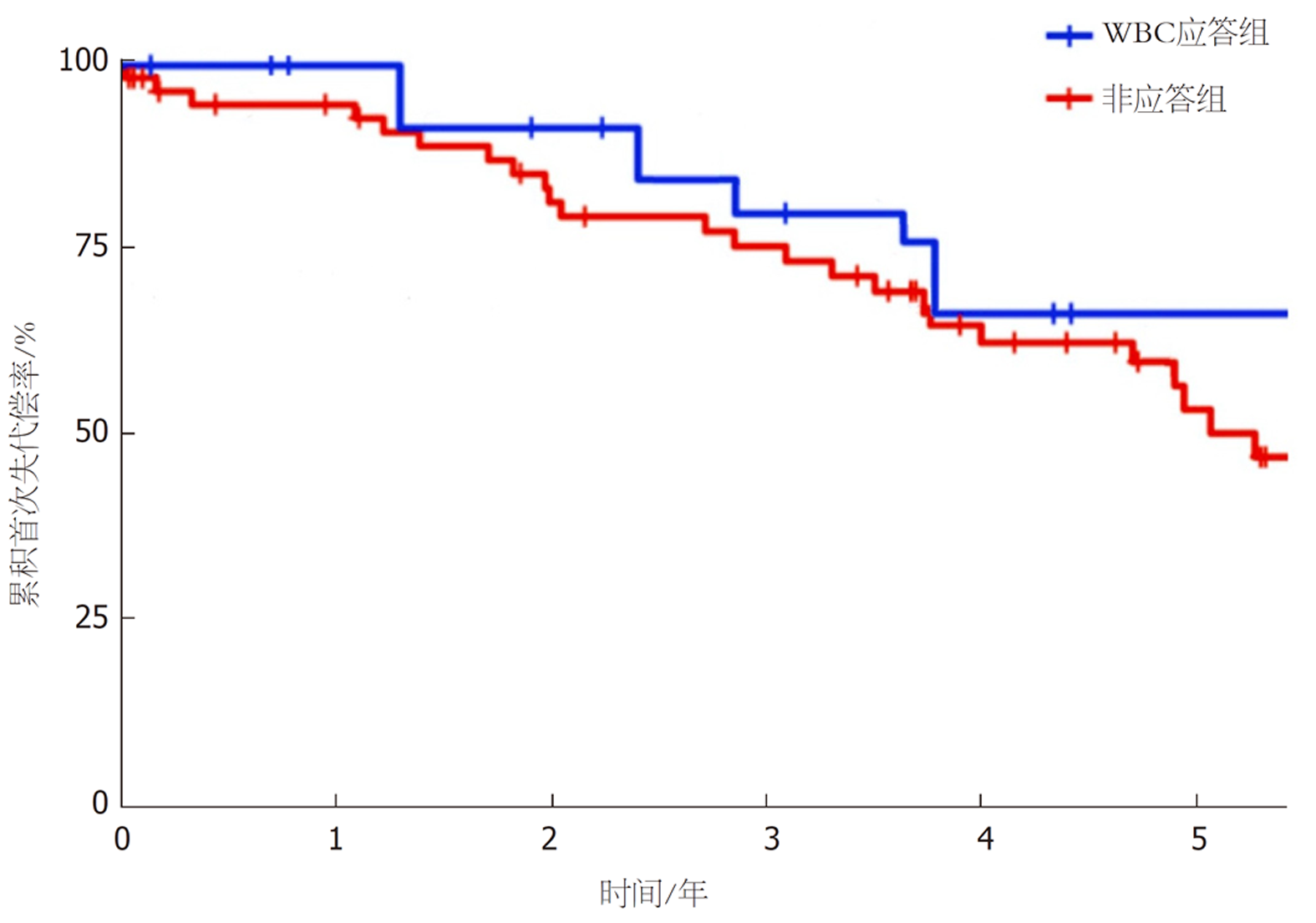
基线无失代偿患者随访情况(共80例): 因肝相关原因病死者有12例(15.00%), WBC应答组与非应答组肝相关病死情况无统计学意义(log-rank检验χ2 = 0.729, P = 0.407); 因非肝相关原因病死者有3例(3.75%), WBC应答组与非应答组非肝相关病死情况无统计学意义(log-rank检验χ2 = 0.684, P = 0.450); 接受肝移植者有4例(5.00%), WBC应答组与非应答组肝移植情况无统计学意义(log-rank检验χ2 = 0.094, P = 0.941); 发生首次失代偿事件者有35例(43.75%), WBC应答组与非应答组非肝相关病死情况无统计学意义(log-rank检验χ2 = 1.301, P = 0.218), 见图3.
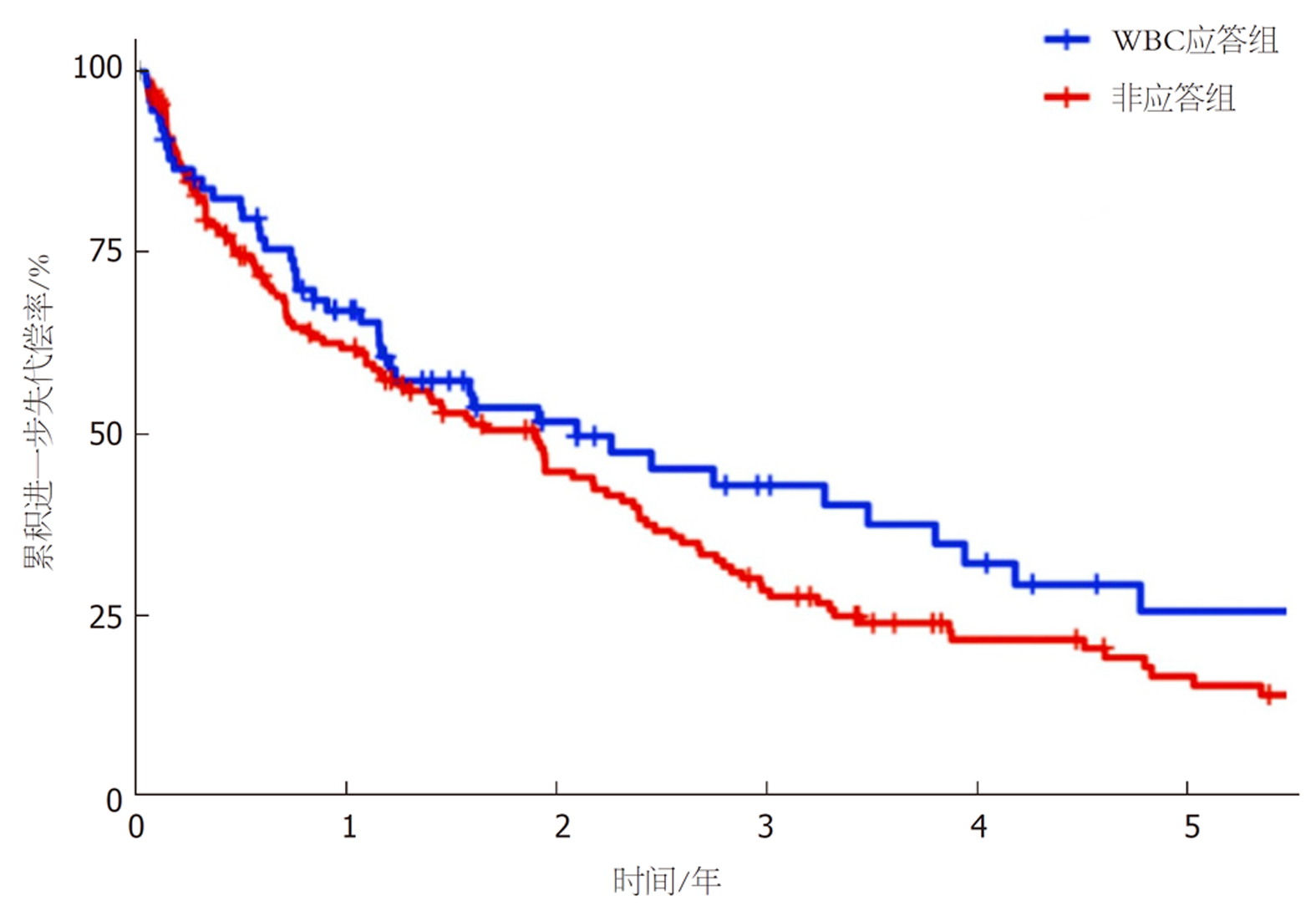
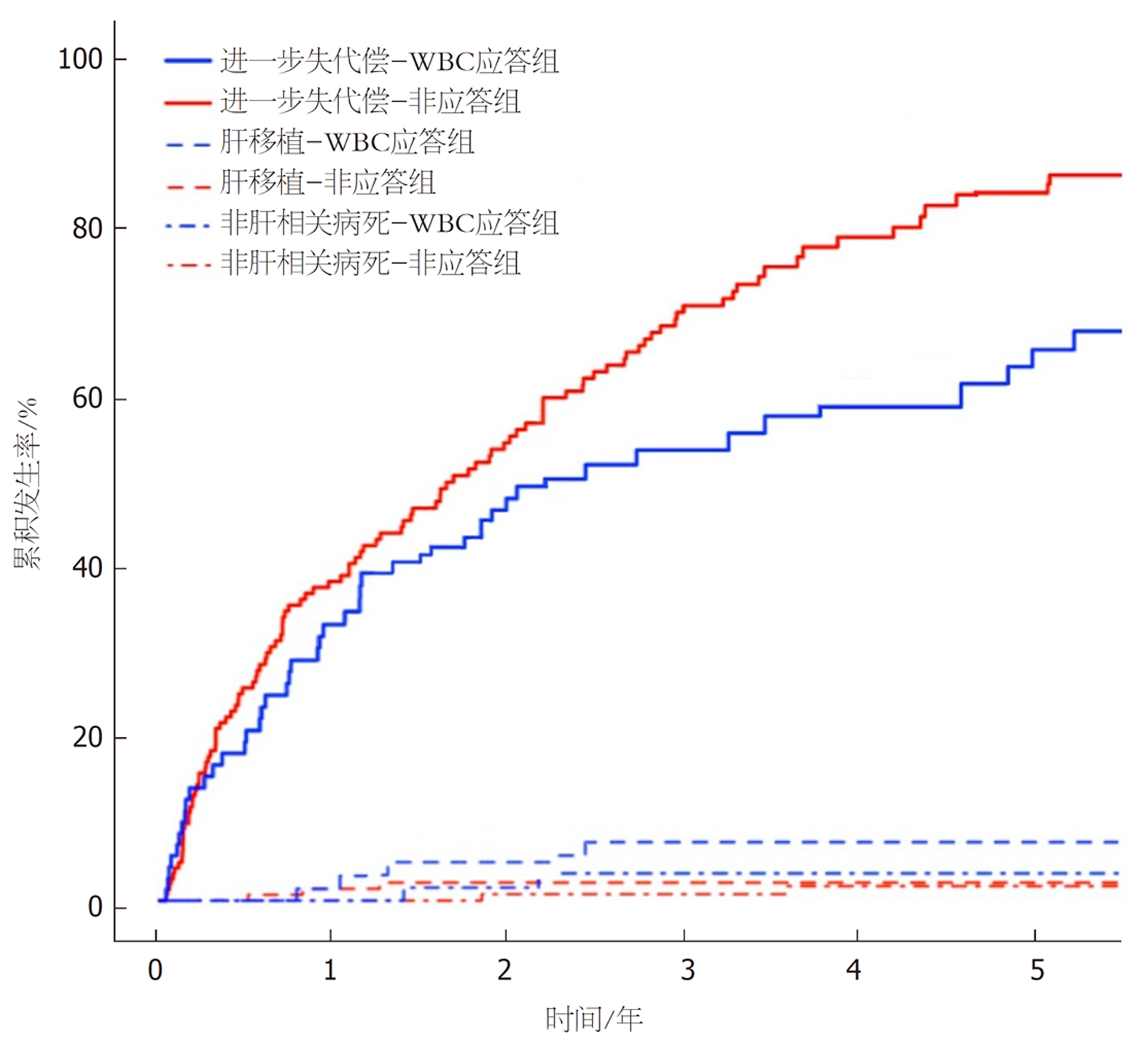
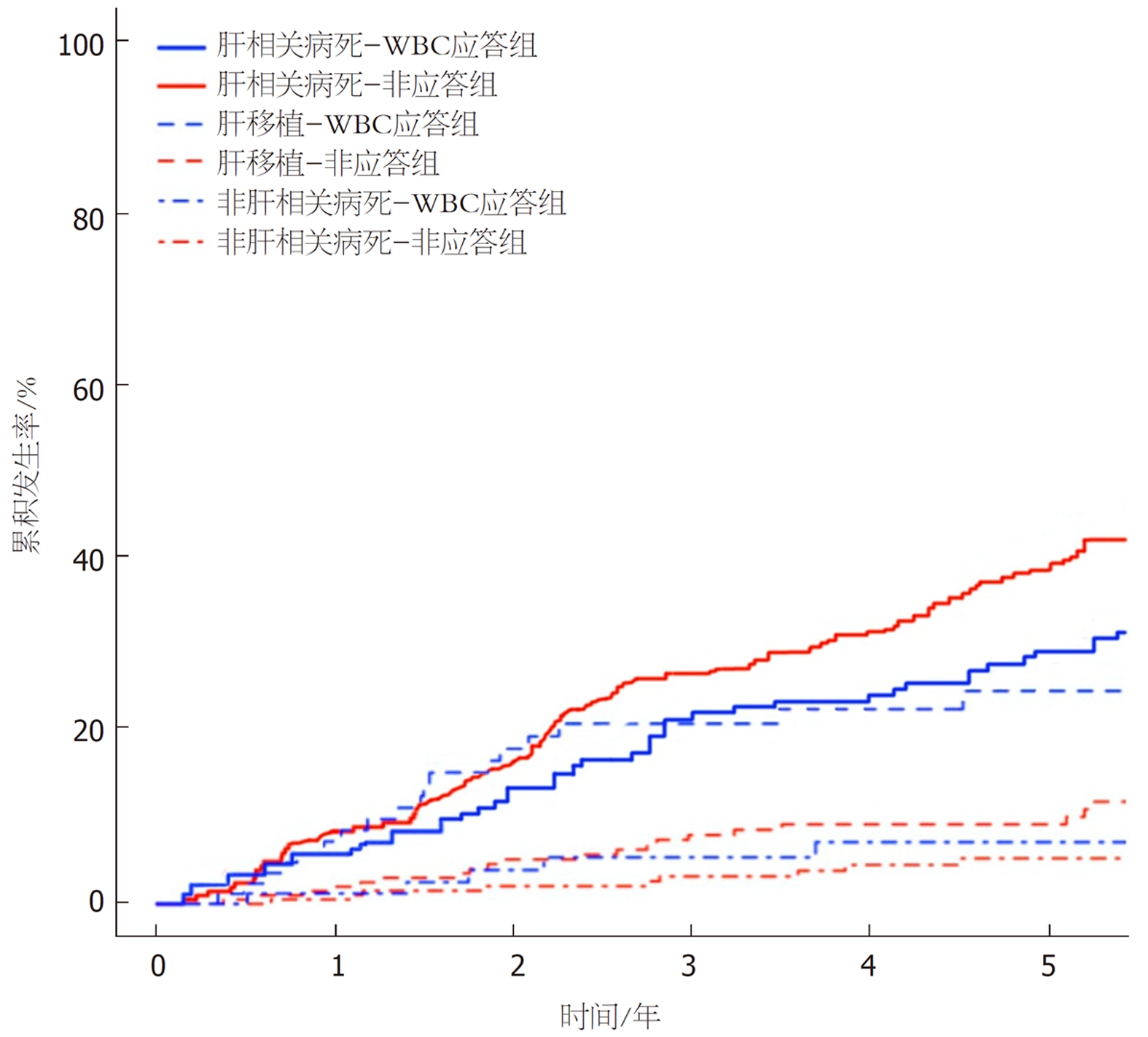
基线失代偿患者随访情况(共239例): 因肝相关原因病死者有108例(45.19%), WBC应答组与非应答组肝相关病死情况无统计学意义(log-rank检验χ2 = 1.586, P = 0.149); 因非肝相关原因病死者有14例(5.86%), WBC应答组与非应答组非肝相关病死情况无统计学意义(log-rank检验χ2 = 0.517, P = 0.695); 接受肝移植者有15例(6.28%), WBC应答组与非应答组肝移植情况有统计学意义(log-rank检验χ2 = 6.812, P = 0.007); 发生进一步失代偿事件者有35例(43.75%), WBC应答组与非应答组进一步失代偿情况无统计学意义(log-rank检验χ2 = 1.843, P = 0.090), 见图4.
将肝移植和非肝相关病死设为竞争风险, 发现WBC应答可降低基线失代偿患者的进一步失代偿风险(HR = 0.708, P<0.05), 见图5、表3. WBC应答是无肝移植者肝相关生存的独立预测因子(HR = 0.582, P<0.05), 见图6、表3. WBC应答增加了肝移植者肝相关病死风险(HR = 1.759, 95%CI = 1.087-2.984, P = 0.040), 见图6.
| 项目 | 单因素分析 | 多因素分析 | ||||
| HR | 95%CI | P | HR | 95%CI | P | |
| 基线无失代偿者首次失代偿的危险因素 | ||||||
| WBC应答(下降≥20%) | 0.680 | 0.182-1.639 | 0.315 | - | - | - |
| 白蛋白(g/L) | 0.971 | 0.842-1.040 | 0.267 | - | - | - |
| MELD-Na评分(分) | 1.163 | 1.032-1.290 | 0.022 | 1.140 | 1.026-1.279 | 0.030 |
| 治疗后的HVPG (mm Hg) | 1.120 | 0.979-1.130 | 0.064 | - | - | - |
| 基线失代偿者进一步失代偿的危险因素 | ||||||
| WBC应答(下降≥20%) | 0.693 | 0.470-0.953 | 0.028 | 0.708 | 0.479-0.974 | 0.034 |
| 腹水严重程度 | 1.298 | 0.945-1.907 | 0.091 | - | - | - |
| 白蛋白(g/L) | 0.980 | 0.942-1.027 | 0.070 | - | - | - |
| MELD-Na评分(分) | 1.027 | 0.984-1.061 | 0.079 | - | - | - |
| 治疗后的HVPG (mm Hg) | 1.039 | 1.028-1.189 | <0.001 | 1.031 | 1.021-1.120 | 0.005 |
| 无移植者肝相关病死率的危险因素 | ||||||
| WBC应答(下降≥20%) | 0.673 | 0.437-1.031 | 0.092 | 0.582 | 0.361-0.798 | 0.014 |
| 年龄(每增加10岁) | 1.250 | 1.110-1.582 | 0.003 | 1.220 | 1.082-1.446 | 0.019 |
| 白蛋白(g/L) | 0.960 | 0.920-0.975 | <0.001 | 0.968 | 0.912-0.980 | 0.034 |
| MELD-Na评分(分) | 1.036 | 1.011-1.127 | 0.028 | - | - | - |
| 治疗后的HVPG (mm Hg) | 1.075 | 1.021-1.140 | <0.001 | 1.065 | 1.006-1.107 | 0.029 |
NSBBs治疗可降低门静脉血流速度及肝内血管阻力, 改善门静脉高压状态[12]. 同时, NSBBs对肝硬化患者还具有抗炎、促进肠动力作用(抑制肠道细菌移位、改善肠道通透性等)[13]. 国外Mookerjee等[14]学者一项针对慢加急性肝衰竭患者的研究也发现, NSBBs治疗可降低此类患者的全身炎症严重程度, 提高生存率. 但目前关于NSBBs潜在抗炎作用的临床证据仍十分有限, 而且尚未明确其抗炎作用是否能够预测晚期慢性肝病患者的长期预后[15].
本研究结果发现, 在使用NSBBs治疗后, 晚期慢性肝病患者的HVPG、WBC、CRP水平明显降低, 进一步证实了NSBBs的预防出血和抗炎作用; 但值得注意的是, 晚期慢性肝病肝硬化可致门脉高压、脾亢, 从而导致白细胞计数减少, 理论来说药物如果能有效降低门脉压、减轻脾亢则白细胞计数会增加, 本研究NSBBs治疗后HVPG降低的同时WBC也明显降低, 可能与NSBBs的抗炎作用较强有关. 刘晓燕等[13]文献综述也报道, NSBBs能增强肝硬化患者肠动力、减少菌群移位以及阻止内皮细胞功能恶化, 从而降低系统性炎症反应, 而且控制脾亢影响因素后, WBC与NSBBs的使用呈负相关. 此外, 本研究结果还发现WBC应答组基线WBC、CRP水平及Child-Pugh分级更高, 提示肝硬化严重程度是系统性炎症状态的主要决定因素, Costa等[16]研究也发现肝硬化严重程度与细菌移位之间的密切联系, 其可能是驱动全身性炎症反应的关键机制, 说明此类患者采用NSBB治疗的抗炎作用更强. 同时, 本研究还发现WBC应答组随访24 mo内的WBC及CRP水平降低更加明显, 且能够在随访期间始终能维持在较低水平, 提示NSBBs对晚期慢性肝病炎症状态的改善作用是可持续的.
既往晚期慢性肝病患者随访过程中常常存在诸多右删失数据(如失访、病死等), 导致无法观察到终点事件, 而且还存在多个相互竞争的事件(如非肝相关病死与进一步失代偿、非肝相关病死与肝相关病死等), 既往学者采用传统的COX回归分析存在HR值偏倚较大等诸多弊端[17,18], 而竞争风险模型则能较好的解决上述问题. 为了进一步明确WBC应答临界值(下降≥20%)对晚期慢性肝病患者进一步失代偿及无移植肝相关病死的预测价值, 本研究采用竞争风险模型进行了研究, 将肝移植和非肝相关病死设为竞争风险, 结果发现除了一些公认的危险因素外, 在NSBBs治疗下达到WBC应答不但可降低基线失代偿患者进一步失代偿风险, 还有助于降低晚期慢性肝病患者与肝相关死亡率. 因此, NSBBs治疗后监测WBC可能是一种简单且可行度较高的临床工具, 有助于医生在随访中及时评估患者的预后效果. 此外, 本研究从竞争风险模型中还发现, 在随访期间WBC反应还与较高的肝移植率相关. 分析原因可能在于WBC应答者在基线时疾病处于更晚期, 此类患者接受肝移植的概率更大, 同时NSBBs治疗后全身性炎症的改善可能有助于延长生存期直到接受移植.
本研究可能存在的弊端: (1)临床中难免会碰到实施抗病毒治疗或存在活动性感染的患者, 还有部分需行经颈静脉肝内门体静脉内支架分流术, 将上述两类患者排除在外可能忽略了疾病自然进程对研究结果的潜在影响; (2)疾病若发展为慢加急性肝衰竭, 不能排除医生可能选择暂时中断有肾功能不全风险患者的NSBBs治疗, 从而限制了慢加急性肝衰竭背景下NSBBs治疗的潜在作用; (3)考虑到WBC应答者疾病更严重, 其全身炎症反应的减轻可能受解决急性失代偿事件的影响而非NSBBs治疗作用, 但本研究大多数患者在基线时疾病稳定, 且应答组与非应答组基线时HVPG等指标并无差异, 应该能减小上述原因导致的偏倚; (4)可能存在部分患者对NSBBs治疗暂时性依从, 使全身性炎症反弹至基线水平引发感染, 并导致肝性脑病或慢加急性肝衰竭的发生.
综上可知, NSBBs有助于改善晚期慢性肝病的炎症反应, 且在Child-Pugh C级患者中表现更明显, WBC下降≥20%可降低进一步失代偿及无肝移植者肝相关病死风险, 临床中值得引起重视, 并充分考虑药物的多重作用, 尽最大努力改善患者预后.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑:刘继红 制作编辑:张砚梁
| 1. | Pimpin L, Cortez-Pinto H, Negro F, Corbould E, Lazarus JV, Webber L, Sheron N; EASL HEPAHEALTH Steering Committee. Burden of liver disease in Europe: Epidemiology and analysis of risk factors to identify prevention policies. J Hepatol. 2018;69:718-735. [PubMed] [DOI] |
| 4. | Simbrunner B, Mandorfer M, Trauner M, Reiberger T. Gut-liver axis signaling in portal hypertension. World J Gastroenterol. 2019;25:5897-5917. [PubMed] [DOI] |
| 6. | 王 省, 吴 斌. 中国肝硬化患者非选择性β受体阻滞剂使用若干问题的思考. 中华消化病与影像杂志(电子版). 2020;10:193-195. [DOI] |
| 7. | Gimenez P, Garcia-Martinez I, Francés R, Gonzalez-Navajas JM, Mauri M, Alfayate R, Almenara S, Miralles C, Palazon JM, Carnicer F, Pascual S, Such J, Horga JF, Zapater P. Treatment with non-selective beta-blockers affects the systemic inflammatory response to bacterial DNA in patients with cirrhosis. Liver Int. 2018;38:2219-2227. [PubMed] [DOI] |
| 8. | Brito-Azevedo A, Perez RM, Coelho HS, Fernandes ES, Castiglione RC, Villela-Nogueira CA, Bouskela E. The anti-inflammatory role of propranolol in cirrhosis: Preventing the inflammatory exhaustion? J Hepatol. 2017;66:240-241. [PubMed] [DOI] |
| 9. | 中国门静脉高压诊断与监测研究组, 中华医学会消化病学分会微创介入协作组, 中国医师协会介入医师分会急诊介入专业委员会, 中华医学会消化病学分会肝胆疾病协作组, 中华医学会外科学分会脾脏及门静脉高压学组, 中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国研究型医院学会肝病专业委员会, 中华预防医学会肝胆胰疾病预防与控制专业委员会, 中华医学会数字医学分会, 中华医学会临床流行病学和循证医学分会. 中国肝静脉压力梯度临床应用专家共识(2018版). 中华消化外科杂志. 2018;17:1059-1070. [DOI] |
| 14. | Mookerjee RP, Pavesi M, Thomsen KL, Mehta G, Macnaughtan J, Bendtsen F, Coenraad M, Sperl J, Gines P, Moreau R, Arroyo V, Jalan R; CANONIC Study Investigators of the EASL-CLIF Consortium. Treatment with non-selective beta blockers is associated with reduced severity of systemic inflammation and improved survival of patients with acute-on-chronic liver failure. J Hepatol. 2016;64:574-582. [PubMed] [DOI] |
| 15. | Jachs M, Hartl L, Schaufler D. Amelioration of systemic inflammation in advanced chronic liver disease upon beta-blocker therapy translates into improved clinical outcomes. Gut. 2020;74:322712. [DOI] |
| 16. | Costa D, Simbrunner B, Jachs M, Hartl L, Bauer D, Paternostro R, Schwabl P, Scheiner B, Stättermayer AF, Pinter M, Trauner M, Mandorfer M, Reiberger T. Systemic inflammation increases across distinct stages of advanced chronic liver disease and correlates with decompensation and mortality. J Hepatol. 2021;74:819-828. [PubMed] [DOI] |
| 17. | 江 晴贵, 李 建军, 郑 晖, 黄 兢姚, 黄 宁, 杨 维竹. 限制性扩张支架对肝硬化门静脉高压经颈静脉肝内门体分流患者预后的影响. 中国介入影像与治疗学. 2021;18:193-197. [DOI] |